Implementazione delle 3R
|
Chi necessita di animali per la ricerca deve inizialmente chiedersi se sia possibile sostituire il modello animale prescelto con metodologie che permetto di raggiungere lo stesso risultato senza l’impiego di animali (Replacement, o Sostituzione). Se ciò è impossibile occorre utilizzare ogni mezzo per ridurre al minimo il numero di individui utilizzati, senza compromettere l’affidabilità del risultato (Reduction, Riduzione). Infine, gli animali utilizzati – a qualunque specie appartengano – devono essere trattati con tutti i mezzi più idonei a rendere le procedure meno impattanti possibile sul loro benessere, riducendo il più possibile qualsiasi tipo di sofferenza eventualmente derivante dalle procedure sperimentali (Refinement, Affinamento). Le “3Rs” si sono evolute nel tempo, anche se i principi di fondo sono rimasti sempre gli stessi e sono ora formalmente integrati nella legislazione europea e nazionale che tutela il benessere degli animali utilizzati per scopi scientifici. |
 |
|
Sostituzione L’obiettivo generale dei progetti di ricerca di base in corso consiste nella comprensione dei meccanismi neuronali soggiacenti a funzioni motorie e socio-cognitive di alto livello che trovano espressione nel repertorio comportamentale di poche altre specie di primati, oltre l’uomo. La prima e più ovvia opzione per sostituire il modello animale consisterebbe dunque nello studiare le stesse funzioni direttamente su soggetti umani. Ciò è effettivamente possibile, e largamente perseguito grazie a tecniche di indagine indirette e non invasive dell’attività cerebrale, come per esempio la risonanza magnetica funzionale, elettroencefalogramma ad alta densità, stimolazione magnetica transcranica e magnetoencefalografia. Inoltre, negli ultimi 20 anni il ricorso a tecniche di monitoraggio elettroencefalografico intracranico prolungato per la valutazione pre-chirurgica della localizzazione di focolai epilettogeni in pazienti con epilessia farmacoresistente ed esami di risonanza magnetica negativi, ha consentito di articolare maggiormente lo studio delle funzioni cerebrali umane con tecniche invasive utilizzate a scopo primariamente clinico (vedi per esempio1). Infine, il ricorso a modelli di simulazione computazionale costituisce un’ulteriore possibilità di integrazione dei dati acquisiti e di formulazione di ipotesi e previsioni empiricamente fondate, ma necessita di dati sperimentali diretti. Tutte insieme, queste tecniche hanno contribuito a ridurre drasticamente il numero di animali, in particolare di primati non-umani (da 8000 a 6000 animali tra il 2008 e il 2011 in Europa, corrispondente ad un -25%, fonte: SCHEER report 2017), utilizzati per la ricerca neuroscientifica. Tuttavia, nessuna di queste tecniche ad oggi applicabili sull’uomo permette di sostituire il modello animale per gli studi a livello di singola cellula e di reti neuronali, poiché nessuna di queste tecniche permette la registrazione dell’attività elettrica di singoli neuroni. Questi studi, possibilmente perseguiti tramite registrazioni simultanee multiple da più regioni cerebrali, costituiscono l’unica via per comprendere causalmente i meccanismi neurofisiologici attraverso cui l’elaborazione integrata a livello di network anatomo-funzionali definiti genera il comportamento, collegando il livello descrittivo di singola cellula col livello di macro-sistema. Questo approccio multidisciplinare e integrato è stato sviluppato, validato, ed è ormai largamente impiegato nella ricerca neuroscientifica su modelli murini2, dove tecniche di manipolazione, anche genetica, di specifiche popolazioni di neuroni consentono un livello di risoluzione senza precedenti nello studio dei vari livelli – molecolare, unitario e di sistema – in cui si articola il funzionamento del cervello3. La complessità dei comportamenti oggetto di studio di questo progetto (abilità di manipolazione fine, comunicazione e interazione sociale, gesti comunicativi) rende impossibile il ricorso a specie diverse dai primati non-umani, e le scimmie del genere Macaca rappresentano la specie a sviluppo neurologico più basso utilizzabile. |
|
|
Le scimmie del genere Macaca (fascicularis e mulatta) costituiscono anche le specie più idonee per gli studi in ambito biomedico e neuroscientifico4 in quanto presentano le omologie anatomo-funzionali, cognitive e comportamentali necessarie e sufficienti per permettere di raggiungere risultati utili ad offrire una comprensione evolutiva e comparativa dei meccanismi neurofisiologici e comportamentali che esse condividono con l’uomo5. Le abilità di movimento degli arti e l’uso fine delle mani per il raggiungimento e manipolazione di oggetti, per esempio, si basano su meccanismi e substrati evolutivamente conservati6. Inoltre, i macachi sono l’unico modello animale disponibile per la ricerca neuroscientifica nel quale sia possibile ritrovare una vasta gamma di comportamenti sociali e affiliativi esplicitamente esibiti mediante posture corporee, comportamenti motori, gesti mimico-facciali e vocalizzazioni, spesso combinati, che realizzano quindi una forma complessa di comunicazione sociale a livello multisensoriale, non paragonabile a quelle che si ritrovano nei roditori o in altre specie a sviluppo neurologico inferiore7. Più specificamente, la specie Macaca mulatta è largamente utilizzata negli studi di neurofisiologia comportamentale anche per la sua eccellente adattabilità e tolleranza alle condizioni di stabulazione e di laboratorio, fatte salve tutte le adeguate misure di arricchimento ambientale e alloggiamento sociale8. Inoltre, essa costituisce la specie più direttamente nota e familiare (rispetto, per esempio, a Macaca fascicularis) per il gruppo di ricerca, i cui membri hanno approfondito biologia ed etologia di questi animali nell’ambito di diversi progetti di ricerca neurofisiologica presso l’Università di Parma precedentemente autorizzati dal Ministero della Salute (Aut. Min. 128/2005-B e 129/2005-B del 20/9/2005, 60/2006-C e 61/2006-B del 20/4/2006, 207/2008-C del 24/11/2008, 54/2010-B e 55/2010-C del 18/3/2010, 294/2012-C del 11/12/2012), nonché durante i corsi FELASA e nelle continue interazioni con i colleghi del German Primate Center di Gottingen, dove Macaca mulatta è la specie più largamente utilizzata in ambito neuroscientifico. |
 Macaca mulatta |
|
Riduzione Negli studi neuroscientifici su primati non numani normalmente non si effettuano disegni sperimentali tra gruppi e la numerosità campionaria non viene definita in termini di animali, bensì in base al numero di misurazioni indipendenti effettuate in modo attendibile e riproducibile sul singolo animale. Tuttavia, in relazione al problema della possibile variabilità interindividuale, e per garantire non solo la solidità ma anche la riproducibilità del dato, è richiesta come standard di base nella letteratura neurofisiologica la dimostrazione di un effetto analogo sui dati ottenuti da un secondo animale. Pertanto, il numero minimo di animali necessario e sufficiente per ciascun esperimento neurofisiologico è tipicamente pari a 2. La possibilità di utilizzare nuove tecnologie per impiegare gli stessi animali in esperimenti diversi (es. iniezione di sostanze farmacologicamente attive e neuroanatomia) consentirà sia di migliorare la qualità dei risultati sia di ridurre il numero di animali necessari ad ottenere le stesse informazioni a parità di danno indotto, ossia senza impatto rilevante in termini di “cumulative severity”.
L’affinamento delle procedure nella ricerca su primati non umani costituisce non soltanto un obbligo etico e legislativo, ma anche uno strumento insostituibile per ottimizzare la compliance degli animali alle condizioni sperimentali e massimizzare la qualità dei dati raccolti (vedi Refinement techniques in non-human primate neuroscientific research). Tutte le procedure previste in questo progetto, dalla stabulazione alle procedure chirurgiche e sperimentali, sono ottimizzate secondo i massimi standard internazionali, e lo sforzo di eliminare definitivamente i sistemi ferma-testa, spostandosi verso l’uso massivo di tecnologie di registrazione wireless dall’animale libero, costituisce un passaggio radicale che va molto oltre gli attuali standard ed incontra le raccomandazioni dei più recenti pronunciamenti a livello europeo in materia (cfr. SCHEER report 2017). Gli animali vengono acquistati da fornitori autorizzati, in grado di garantire la disponibilità di animali nati in cattività da genitori a loro volta nati in cattività (F2 – quindi nessun animale utilizzato o genitori di esso vengono mai direttamente prelevati dallo stato selvatico). Gli animali vengono trasportati da personale formato e autorizzato, con mezzi idonei. Dalla loro acquisizione in poi, adottando la prospettiva del miglioramento complessivo della “cumulative life-time experience”, le misure di affinamento per gli animali riguardano tutti gli aspetti gestionali, dalla stabulazione alle procedure sperimentali, come segue. ▪ Formazione di tutto il personale. La valutazione, monitoraggio, e ottimizzazione dell’ambiente e delle procedure durante l’intero ciclo di vita degli animali possono portare a sostanziali benefici soltanto nella misura in cui siano seguite da personale esperto e adeguatamente formato allo scopo. Per questa ragione, tutto il personale con responsabilità dirette sulle procedure o sulla gestione quotidiana degli animali riceve un’adeguata formazione specifica di tipo teorico-pratico, dimostrata dal conseguimento di certificazione FELASA A e B specifica per il lavoro con primati non-umani a scopo sperimentale prima di iniziare qualsiasi interazione con gli animali. Il continuo confronto con il personale (colleghi e veterinari) che opera in altri centri primatologici europei è frutto di aggiornamento e formazione continua che si aggiungono all’aggiornamento periodico dello staff ottenuto mediante la partecipazione a seminari ed eventi specifici in materia di 3R e benessere animale. |
|
|
▪ Stabulazione e arricchimento ambientale. Un sistema di gabbie comunicanti conforme alla direttiva europea 63/2010 (e al Dlgs 26/2014), progettato e realizzato da un’azienda leader nel settore in collaborazione con i maggiori centri primatologici europei, ospita gli animali in coppia offrendo spazi superiori ai minimi di legge (minimo 2.5 m3 per animale, contro 1.8m3 previsti dalle leggi vigenti). L’ambiente viene gestito secondo un programma di rotazione giornaliera degli arricchimenti che comprendono specchi, diversi oggetti traforati per il “foraging”, un substrato in segatura o corteccia naturale in cui disperdere semi e altri piccoli cibi che gli animali cercano attivamente, giocattoli sospesi e liane. Lo stabulario comprende anche un’ampia “gabbia ricreazione” dotata di un albero e un’altalena che permettono agli animali di arrampicarsi e saltare: le coppie di animali vengono fatte accedere secondo una turnazione quotidiana prestabilita alla gabbia ricreazione, consentendo loro di mantenere attivo ed esercitare l’intero repertorio comportamentale specie-specifico. È presente un sistema di diffusione sonora e monitor per la proiezione di video che costituiscono un arricchimento sensoriale e cognitivo molto gradito agli animali. L’ambiente è dotato di numerose e ampie finestre per garantire un’illuminazione naturale ottimale e mantenere regolari cicli notte/giorno (oltre ad un sistema controllato da timer per garantire il controllo dell’illuminazione artificiale/spegnimento delle luci in ore notturne), di un sistema di controllo e gestione della temperatura collegato a sistemi di allarme attivi 24h/24 e 7gg/7. La gestione igienico-sanitaria dell’ambiente e la nutrizione quotidiana degli animali è curata da apposito personale tecnico debitamente formato che opera sulla base delle indicazioni e sotto la supervisione del personale ricercatore e del referente locale per il benessere animale. |
 |
|||
|
▪ Addestramento mediante rinforzo positivo. Tutti gli animali vengono addestrati alle basilari forme di interazione con gli sperimentatori e con le attrezzature di laboratorio già in gabbia, mediante esplorazione spontanea dell’animale con tecniche di auto-addestramento computerizzato9 10 o in presenza di personale e, in ogni caso, rinforzo positivo. L’addestramento vero e proprio all’esecuzione dei compiti sperimentali richiede un periodo, variabile da animale ad animale, di familiarizzazione con gli sperimentatori, che iniziano ad interagire con l’animale impartendo semplici comandi attraverso la gabbia e rinforzandolo con frutta ed altro cibo gradito, diverso da quello secco normalmente fornito come razione giornaliera di base. Le procedure di abituazione, come tutte quelle di addestramento specifico successive, saranno eseguite da personale competente, mediante tecniche di condizionamento operante basate su rinforzo positivo11. Il clicker-training verrà sistematicamente impiegato per facilitare e accelerare l’apprendimento, associando ai comportamenti corretti una immediata conseguenza acustica che prelude all’erogazione della ricompensa12 13. Gli animali destinati a sessioni sperimentali in cui è inevitabile il fissaggio della testa vengono progressivamente addestrati ad avvicinarsi, entrare, e rimanere nella sedia per primati passando autonomamente dalla gabbia alla sedia, evitando l’uso di collari o distanziatori rigidi14 e optando per metodologie il più possibile basate sulla disponibilità dell’animale a cooperare attivamente, premessa cruciale per il buon esito delle successive procedure sperimentali in laboratorio.
Questo tipo di procedura può richiedere fino ad 1 anno, in particolare per la delicata fase di abituazione degli animali ad accettare ripetutamente, in giornate successive, la limitata mobilità sulla sedia per primati: la gradualità è necessaria per evitare il rischio del rifiuto a cooperare, che richiede altrimenti di riprendere l’addestramento ripartendo da una fase precedente a quella già raggiunta. Molto più semplice e veloce risulta invece l’addestramento degli animali ai quali non debba essere impiantato il sistema di fissaggio della testa, e per i quali non è dunque necessario l’uso della sedia per primati: gli animali necessitano solo di poche settimane per passare, generalmente senza manifestare alcun segno di stress, disagio o rifiuto a collaborare, dalla gabbia a trasportini in plexiglass trasparente mediante i quali possono essere trasferiti nell’ambiente attrezzato per le registrazioni wireless. La validazione di queste procedure e delle metodologie di registrazione wireless potrà permettere, nel prossimo futuro, l’eliminazione completa dei dispositivi di fissaggio della testa e delle sedie per primati per un considerevole numero di studi, contribuendo in tal modo in maniera sostanziale al raffinamento delle procedure. L’addestramento specifico ai compiti necessari per gli esperimenti viene eseguito con le stesse modalità, adottando metodologie comportamentali strutturate come l’analisi del compito, la scomposizione del comportamento globale nei suoi componenti elementari, il rinforzo differenziale di comportamenti spontanei che si approssimano sempre più al comportamento bersaglio, lo shaping della risposta e il fade-out degli stimoli cue utilizzati come step intermedi per le fasi più complesse dei compiti. L’obiettivo generale in queste procedure consiste nel selezionare, rinforzandoli, quei comportamenti tra quelli che l’animale è immediatamente in grado di esibire che più si avvicinano al comportamento bersaglio desiderato: in questo modo, il rinforzo di tali comportamenti e la concomitante estinzione di quelli alternativi non desiderati portano progressivamente all’emergere di abilità che ottemperano alle richieste di compiti anche molto complessi da un punto di vista cognitivo. Queste modalità sono esattamente le stesse utilizzate dai migliori addestratori di cinofili. |
||||
|
|
||||
|
▪ Miniaturizzazione e raffinamento dei dispositivi invasivi. Tutti i dispositivi da impiantare chirurgicamente sugli animali (come il sistema di interconnessione per il trasmettitore wireless) sono realizzati in materiali biocompatibili riducendone al massimo le dimensioni. I probe multielettrodici utilizzati hanno un diametro generalmente compreso tra 50 e 100µm, tale da causare un danno tissutale trascurabile, come evidenziato da analisi istologiche condotte in un precedente studio15. I dispositivi ferma-testa in uso, impiegati solo dove necessario, si sono dimostrati particolarmente ben tollerati, mostrando un’eccellente osteo-integrazione evidenziata anche da esami post-mortem16 e non causano quindi alcun problema all’animale. Un ulteriore ed importante elemento di affinamento è costituito dalla conservazione dell’osso cranico intatto sulla regione di interesse per diverse procedure, e l’adozione di approcci di registrazione cronica o semi-cronica nei quali non è prevista nessuna procedura in grado di arrecare anche il minimo fastidio all’animale dopo l’impianto dei probe siliconici, molto semplice e veloce ma comunque effettuato in anestesia generale. L’approccio cronico rende possibile minimizzare anche la manipolazione dell’animale prima di ogni sessione di registrazione, elimina o riduce drasticamente il rischio di processi infettivi o infiammatori, e contribuisce quindi ulteriormente a migliorare il benessere animale. |
 |
|||
| ▪ Anestetici, tecniche chirurgiche e trattamento farmacologico post-operatorio. Tutte le procedure chirurgiche maggiori sono eseguite alla presenza del veterinario designato, in anestesia generale gassosa con erogazione di alogenati eseguita personalmente da un veterinario con certificazione di competenza FELASA per il lavoro con primati non-umani e con ampia esperienza in ambito anestesiologico su diverse specie di animali. Il controllo intraoperatorio dei principali parametri fisiologici (temperatura, frequenza respiratoria, spirometria, saturazione parziale d’ossigeno, frequenza cardiaca, tracciato elettrocardiografico e pressione arteriosa con metodica non invasiva) è garantito da un monitor multiparametrico gestito dall’anestesista. Un neurochirurgo è disponibile con funzione di supervisione e aggiornamento e in tutte le procedure chirurgiche in cui si renda necessario. Il decorso post-operatorio è monitorato dal personale responsabile della gestione dell’animale sotto la diretta supervisione del veterinario designato e del veterinario anestesista, che prescrivono la terapia farmacologica (antibiotica, antinfiammatoria e analgesica) da somministrare nel decorso post-operatorio fino a completo recupero. |
 |
|||
| ▪ Tecniche di registrazione che massimizzano la quantità e qualità dei dati, riducendo numero e durata delle sessioni. Un ulteriore importante elemento di raffinamento consiste nell’ottimizzazione dell’utilizzo della risonanza magnetica negli animali in anestesia allo scopo di ottenere immagini anatomiche della morfologia del cranio e del cervello. La ricostruzione in 3D di un modello plastico del cranio di ciascun animale consente di conformare in maniera anatomica i dispositivi da impiantare secondo la struttura specifica dell’osso: i risultati ottenuti fino ad ora con questa tecnica hanno mostrato la possibilità di ottenere impianti molto più leggeri, meno invasivi e che non richiedono alcuna operazione di mantenimento, disinfezione o pulizia. Lo studio della morfologia del cervello invece, permette di identificare con precisione la localizzazione anatomica della regione di interesse, ed è alla base della possibilità di utilizzare probes semi-permanenti impiantati precisamente nella regione di interesse. La registrazione simultanea multicanale permette di acquisire l’attività da centinaia di siti cerebrali simultaneamente, utilizzando soltanto pochi probe dotati di numerosi siti di registrazione ciascuno. Il monitoraggio di parametri comportamentali come la cinematica del movimento o la posizione oculare può essere effettuato con metodologie totalmente non invasive, basate su sistemi di telecamere sensibili all’infrarosso e apposite sorgenti di luce infrarossa che permettono di mantenere la massima stabilità del segnale in tutte le condizioni di illuminazione con luce nello spettro visibile. |
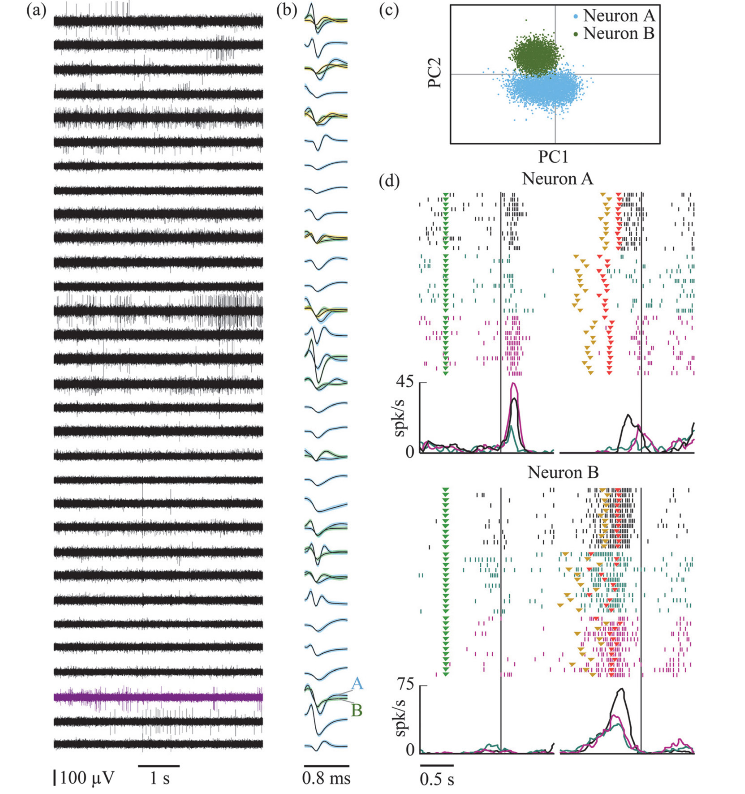 |
| ▪ Utilizzo degli stessi animali per studi neurofisiologici e neuroanatomici, senza impatto in termini di “cumulative-severity”. È importante sottolineare che l’intervento di impianto dei probe intracorticali non causa di per sé alcun danno rilevante e conseguentemente alcuna sofferenza all’animale. Gli studi neuroanatomici finalizzati a definire direttamente la connettività delle regioni studiate elettrofisiologicamente si svolgono esattamente nello stesso modo, impiantando un “injectrode” anziché un semplice probe. Gli “injectrode” sono di fatto probe siliconici equipaggiati con uno o più canali di microfluidica attraverso i quali è possibile iniettare sia piccole quantità (nell’ordine dei microlitri) di sostanze farmacologicamente attive o, alla fine degli esperimenti, traccianti neuronali. Questi ultimi vengono trasportati per via retrograda o antero-retrograda e permettono, dopo un adeguato periodo di tempo di in relazione al tracciante iniettato, di verificare direttamente, post-mortem, la connettività anatomica della regione studiata. Gli studi neuroanatomici non richiedono pertanto alcuna chirurgia o procedura specifica aggiuntiva rispetto a quelle già previste e descritte per gli studi neurofisiologici, non richiedono animali “dedicati” e non possono produrre effetti additivi rilevanti in termini di “gravità cumulativa”. L’animale viene soppresso mediante eutanasia indolore con le metodiche previste dalla legge per la specie al termine degli esperimenti neurofisiologici, al fine di consentire di ricostruire l’anatomia e le connessioni del cervello studiato. Gli animali sono in perfette condizioni di salute psico-fisica al momento dell’eutanasia, in quanto la soppressione eutanasica è necessaria per la ricostruzione delle proprietà anatomiche e delle connessioni delle regioni studiate. Per questa ragione non sono al momento possibili progetti di ricollocamento dell’animale alla fine degli esperimenti, altrimenti perseguibili. Le tecniche di trattografia anatomica basate sulla risonanza magnetica sono ancora estremamente grossolane e imprecise, scarsamente affidabili e riproducibili, e non rappresentano in alcun modo un’alternativa anche soltanto paragonabile agli studi neuroanatomici con utilizzo di traccianti. Non appena il progresso delle suddette tecniche di trattografia anatomica non-invasiva dovesse consentire di ottenere dati di qualità sufficiente oppure nei casi in cui non fosse necessaria la ricostruzione del network anatomico sugli animali studiati, verrà considerata la possibilità di ricollocare gli animali in appositi centri di recupero al termine degli esperimenti. |
|
| ▪ Monitoraggio continuo del benessere animale. Nonostante tutte le misure descritte sino ad ora, è ovvio che in qualsiasi fase è possibile il verificarsi di eventi avversi e imprevedibili in grado di compromettere in vario grado il benessere dell’animale. Si tiene a precisare che eventi avversi di questo tipo (traumi incidentali, ferite da conflitto col partner, infezioni transitorie o disfunzioni organiche non riconducibili a procedure sperimentali) possono accadere, come per qualsiasi animale domestico, anche in assenza di alcuna relazione con le procedure sperimentali stesse. Per far fronte ai possibili effetti negativi di tali eventi, un’ulteriore importante misura generale di raffinamento consiste nel monitoraggio costante del benessere animale operato da personale formato e qualificato (vedi punto a) utilizzando come riferimento un’apposita scheda di valutazione clinica predisposta, per ciascun animale, al momento del suo accesso in stabulario, e mantenuta aggiornata quotidianamente per l’intero ciclo di vita. Gli animali dello stabulario sono monitorati quotidianamente e vengono registrate informazioni che vanno ben oltre quelle richieste dal “personal history file” previsto dalla normativa vigente. In particolare, tutti gli animali inseriti in una procedura, anche soltanto in fase di training, interagiscono con o vengono osservati da almeno uno sperimentatore o tecnico che lavora quotidianamente con l’animale, e può quindi rilevare e annotare qualsiasi possibile deviazione dalle condizioni normali e ottimali di benessere, oltre ad informazioni quali la quantità e tipologia di cibo e liquidi consumati, l’eventuale misurazione non invasiva del peso corporeo (per gli animali che salgono in sedia o nel trasportino), eventi o comportamenti particolari degni di nota, la tipologia di arricchimento fornita e la propensione dell’animale ad interagirvi, nonché informazioni qualitative e quantitative relative alla performance nell’addestramento o nell’esecuzione dei compiti sperimentali. Queste informazioni consentono di modulare e ottimizzare anche le procedure di addestramento, adeguandole alle caratteristiche individuali del singolo animale. |
|
Referenze
[1] F. Caruana et al., “Decomposing Tool-Action Observation: A Stereo-EEG Study,” Cereb. Cortex, vol. 27, no. 8, pp. 4229–4243, Aug. 2017.
[2] G. Buzsáki et al., “Tools for Probing Local Circuits: High-Density Silicon Probes Combined with Optogenetics,” Neuron, vol. 86, no. 1, pp. 92–105, 2015.
[3] P. Tovote, J. P. Fadok, and A. Lüthi, “Neuronal circuits for fear and anxiety,” Nat. Rev. Neurosci., vol. 16, p. 317, May 2015.
[4] P. K. A. et al., “Why primate models matter,” Am. J. Primatol., vol. 76, no. 9, pp. 801–827, Aug. 2014.
[5] K. J. H., “The evolution of brains from early mammals to humans,” Wiley Interdiscip. Rev. Cogn. Sci., vol. 4, no. 1, pp. 33–45, Nov. 2012.
[6] E. Borra, M. Gerbella, S. Rozzi, and G. Luppino, “The macaque lateral grasping network: A neural substrate for generating purposeful hand actions,” Neurosci. Biobehav. Rev., vol. 75, pp. 65–90, 2017.
[7] J. Fooden, “Systematic review of the rhesus macaque, Macaca mulatta (Zimmermann, 1780).,” FieldianaZoology, vol. 96, pp. 1–180, 2000.
[8] H. D. L., B. Eliza, V. Jessica, M. Brenda, and C. John, “Laboratory rhesus macaque social housing and social changes: Implications for research,” Am. J. Primatol., vol. 79, no. 1, p. e22528, Dec. 2016.
[9] A. Calapai et al., “A cage-based training, cognitive testing and enrichment system optimized for rhesus macaques in neuroscience research,” Behav. Res. Methods, vol. 49, no. 1, pp. 35–45, Feb. 2017.
[10] C. R. Ponce, M. P. Genecin, and M. S. Livingstone, “Automated chair-training of rhesus macaques,” J. Neurosci. Methods, vol. 263, pp. 75–80, 2016.
[11] G. E. Laule, M. A. Bloomsmith, and S. J. Schapiro, “The Use of Positive Reinforcement Training Techniques to Enhance the Care, Management, and Welfare of Primates in the Laboratory,” J. Appl. Anim. Welf. Sci., vol. 6, no. 3, pp. 163–173, Jul. 2003.
[12] S. J. Schapiro, M. A. Bloomsmith, and G. E. Laule, “Positive reinforcement training as a technique to alter nonhuman primate behavior: Quantitative assessments of effectiveness,” Journal of Applied Animal Welfare Science, vol. 6, no. 3. pp. 175–187, 2003.
[13] A. L. Fernström, H. Fredlund, M. Spångberg, and K. Westlund, “Positive reinforcement training in rhesus macaques-training progress as a result of training frequency,” Am. J. Primatol., vol. 71, no. 5, pp. 373–379, 2009.
[14] L. Scott, P. Pearce, S. Fairhall, N. Muggleton, and J. Smith, “Training nonhuman primates to cooperate with scientific procedures in applied biomedical research,” Journal of Applied Animal Welfare Science, vol. 6, no. 3. pp. 199–207, 2003.
[15] F. Barz et al., “Versatile, modular 3D microelectrode arrays for neuronal ensemble recordings: From design to fabrication, assembly, and functional validation in non-human primates,” J. Neural Eng., vol. 14, no. 3, 2017.
[16] A. Kohn, “Visual Adaptation: Physiology, Mechanisms, and Functional Benefits,” J. Neurophysiol., vol. 97, no. 5, pp. 3155–3164, May 2007.

